Cefdinir (JP14/USAN)




Categoria
Cefdinir (JP14/USAN) Marchi, Cefdinir (JP14/USAN) Analoghi
Cefdinir (JP14/USAN) Marchi miscela
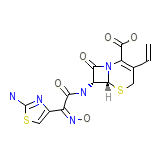
Cefdinir (JP14/USAN) Formula chimica
C14H13N5O5S2
Cefdinir (JP14/USAN) RX link
http://www.rxlist.com/cgi/generic2/cefdin.htm
Cefdinir (JP14/USAN) FDA foglio
Cefdinir (JP14/USAN) DMS (foglio di materiale di sicurezza)
Cefdinir (JP14/USAN) Sintesi di riferimento
Nessuna informazione disponibile
Cefdinir (JP14/USAN) Peso molecolare
395.416 g/mol
Cefdinir (JP14/USAN) Temperatura di fusione
No information avaliable
Cefdinir (JP14/USAN) H2O Solubilita
Nessuna informazione disponibile
Cefdinir (JP14/USAN) Stato
Solid
Cefdinir (JP14/USAN) LogP
0.657
Cefdinir (JP14/USAN) Forme di dosaggio
Capsule per somministrazione orale (300mg), sospensione orale (125 mg per ogni soluzione di 5 ml)
Cefdinir (JP14/USAN) Indicazione
Per il trattamento delle vie respiratorie, pelle, tessuti molli e infezioni ORL causate da H. influenzae (compresi i ceppi b-lattamasi produttori), H. parainfluenzae (comprese b-lattamasi ceppi produttori) ), S. pneumoniae (penicillina-ceppi sensibili), S. pyogenes, S. aureus (compresi i ceppi b-lattamasi produttori), e M. catarrhalis.
Cefdinir (JP14/USAN) Farmacologia
Cefdinir è una cefalosporina di terza generazione con un ampio spettro di attività contro enterici gram-negativi. Cefdinir è stabile in presenza di alcuni, ma non tutti, i b-lattamasi enzimi. Come risultato, molti organismi resistenti alle penicilline e cefalosporine alcuni sono suscettibili di cefdinir. Cefalosporine funzionano allo stesso modo come penicilline: esse interferiscono con la sintesi del peptidoglicano dei batteri muro inibendo la transpeptidazione finale necessario per il cross-link. Questo effetto è battericida.
Cefdinir (JP14/USAN) Assorbimento
Raggiungere la massima concentrazione plasmatica si verificano cefdinir 2 a 4 ore post-dose o la somministrazione della capsula dopo sospensione. Biodisponibilità delle capsule cefdinir stimato è del 21% dopo somministrazione di una 300 mg capsula, e il 16% in seguito alla somministrazione di una dose di 600 mg capsula. Biodisponibilità assoluta stimata della sospensione cefdinir è del 25%. L'assorbimento è ridotto di circa il 15% quando somministrata con un pasto ricco di grassi.
Cefdinir (JP14/USAN) Tossicita
Informazioni sul sovradosaggio cefdinir nell'uomo non è disponibile. Negli studi di tossicità acuta nei roditori, una singola dose orale 5600-mg/kg non ha prodotto effetti negativi. Segni tossici e seguenti sintomi sovradosaggio con altri b-lattamici hanno incluso nausea, vomito, dolore epigastrico, diarrea e convulsioni.
Cefdinir (JP14/USAN) Informazioni paziente
Cefdinir (JP14/USAN) Atto interessato organismi
Enterici gram-negativi