DEA No. 9720




Categoria
DEA No. 9720 Marchi, DEA No. 9720 Analoghi
DEA No. 9720 Marchi miscela
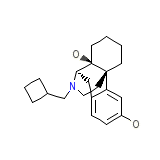
DEA No. 9720 Formula chimica
C21H29NO2
DEA No. 9720 RX link
http://www.rxlist.com/cgi/generic2/butor.htm
DEA No. 9720 FDA foglio
DEA No. 9720 DMS (foglio di materiale di sicurezza)
DEA No. 9720 Sintesi di riferimento
Nessuna informazione disponibile
DEA No. 9720 Peso molecolare
327.461 g/mol
DEA No. 9720 Temperatura di fusione
No information avaliable
DEA No. 9720 H2O Solubilita
Moderato
DEA No. 9720 Stato
Solid
DEA No. 9720 LogP
4.176
DEA No. 9720 Forme di dosaggio
Gocce; premix tossicodipendenze; Gel, Globuli; liquidi; Polvere per soluzione; soluzione; Spray; Tablet
DEA No. 9720 Indicazione
Per la gestione del dolore quando l'uso di un analgesico oppioide è appropriato. Anche indicato come terapia preoperatoria o preanesthetic, come supplemento al anestesia bilanciata, e per il sollievo del dolore durante il travaglio.
DEA No. 9720 Farmacologia
Butorfanolo è un oppiaceo sintetico agonista-antagonista analgesico con un profilo farmacologico e terapeutico che è stato ben stabilito dal suo lancio come una formulazione parenterale nel 1978. L'introduzione di una formulazione transnasale di butorfanolo rappresenta una nuova presentazione e non invasiva di un analgesico per il dolore da moderato a grave. Questa via di somministrazione aggira il tratto gastrointestinale, e questo è un vantaggio per un farmaco come il butorfanolo che subisce un significativo metabolismo di primo passaggio dopo somministrazione orale. L'inizio di azione e biodisponibilità sistemica di seguire butorfanolo consegna transnasale sono simili a quelli dopo somministrazione parenterale. Butorfanolo blocchi impulsi del dolore in siti specifici nel cervello e nel midollo spinale.
DEA No. 9720 Assorbimento
Rapidamente assorbita dopo iniezione intramuscolare e livelli plasmatici di picco sono raggiunti in 20-40 minuti. La biodisponibilità assoluta è del 60-70% ed è rimasta invariata nei pazienti con rinite allergica. In pazienti usando un vasocostrittore nasale (ossimetazolina) la frazione della dose assorbita è rimasto invariato, ma il tasso di assorbimento è stato rallentato. La biodisponibilità orale è solo a causa del 5-17% di primo passaggio metabolismo.
DEA No. 9720 Tossicita
Le manifestazioni cliniche di sovradosaggio butorfanolo sono quelli dei farmaci oppioidi in genere. I sintomi più gravi sono ipoventilazione, insufficienza cardiovascolare, coma e morte.
DEA No. 9720 Informazioni paziente
DEA No. 9720 Atto interessato organismi
Gli esseri umani e altri mammiferi