Omnicef (TN)




Categorie
Omnicef (TN) Les marques, Omnicef (TN) Analogs
Omnicef (TN) Les marques melange
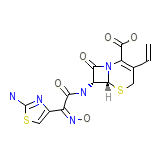
Omnicef (TN) Formule chimique
C14H13N5O5S2
Omnicef (TN) RX lien
http://www.rxlist.com/cgi/generic2/cefdin.htm
Omnicef (TN) FDA fiche
Omnicef (TN) msds (fiche de securite des materiaux)
Omnicef (TN) Synthese de reference
Aucune information disponible
Omnicef (TN) Poids moleculaire
395.416 g/mol
Omnicef (TN) Point de fusion
No information avaliable
Omnicef (TN) H2O Solubilite
Aucune information disponible
Omnicef (TN) Etat
Solid
Omnicef (TN) LogP
0.657
Omnicef (TN) Formes pharmaceutiques
Gélules pour administration orale (300mg), la suspension orale (125mg par solution 5 ml)
Omnicef (TN) Indication
Pour le traitement des voies respiratoires, la peau, des tissus mous, et les infections ORL causée par H. influenzae (y compris les b-lactamase souches productrices), H. parainfluenzae (y compris les b-lactamase souches productrices) ), S. pneumoniae (souches sensibles à la pénicilline), S. pyogenes, Staphylococcus aureus (y compris les b-lactamase souches productrices), et M. catarrhalis.
Omnicef (TN) Pharmacologie
Cefdinir est une céphalosporine de troisième génération avec un large spectre d'activité contre les gastro-Gram négatif. Cefdinir est stable en présence de certains, mais pas tous, b-lactamase enzymes. En conséquence, de nombreux organismes résistants aux pénicillines et certaines céphalosporines sont sensibles à cefdinir. Céphalosporines de travail de la même façon que les pénicillines: ils interfèrent avec la synthèse du peptidoglycane de bactéries mur en inhibant la transpeptidation final nécessaire pour les liens inter-. Cet effet est bactéricide.
Omnicef (TN) Absorption
Concentrations maximales plasmatiques cefdinir produire 2 à 4 heures post-dose suivants capsule ou l'administration de suspension. Biodisponibilité estimée de capsules cefdinir est de 21% après administration d'une 300 dose de mg, gélule, et 16% après administration d'une dose de 600 mg capsule. Estimation biodisponibilité absolue de la suspension cefdinir est de 25%. L'absorption est réduite d'environ 15% lorsqu'il est administré avec un repas riche en graisses.
Omnicef (TN) Toxicite
Information sur le surdosage chez l'homme cefdinir n'est pas disponible. Dans les études de toxicité aiguë chez les rongeurs, une dose orale unique 5600-mg/kg produit pas d'effets indésirables. Signes et symptômes toxiques suite d'un surdosage avec d'autres b-lactamines ont inclus des nausées, des vomissements, douleurs épigastriques, diarrhée et des convulsions.
Omnicef (TN) Information pour les patients
Omnicef (TN) Organismes affectes
Entériques à Gram négatif